MDR - Regolamento Dispositivi Medici
Quali sono i principali vantaggi?

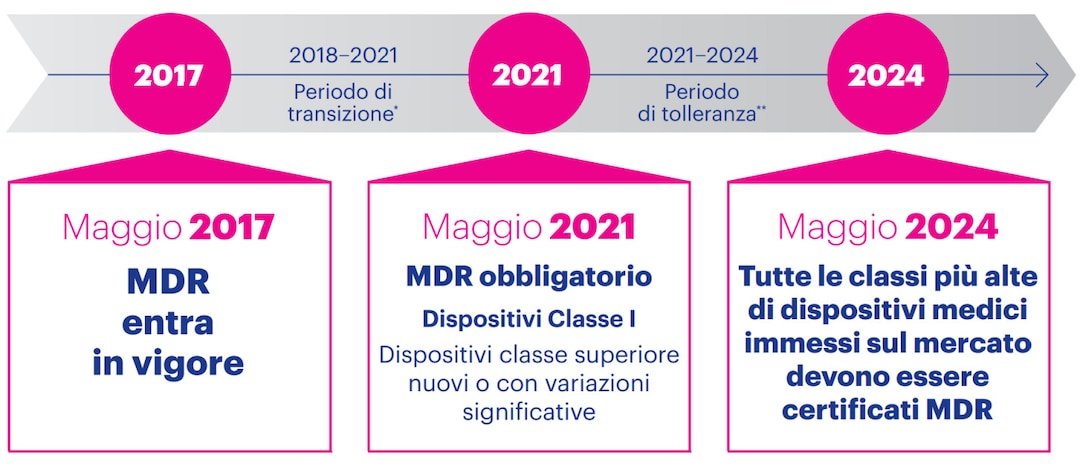
Quando verra' applicato l’MDR?
Come cliente, cosa fare?

Consulta qui le Q&A per avere maggiori dettagli
* I dispositivi medico-diagnostici in vitro saranno disciplinati dal regolamento separato (UE) 2017/746. Poiché Essity non vende dispositivi medico-diagnostici in vitro, l’MDR si applicherà quindi a tutti i dispositivi medici Essity.
** Periodo di transizione per designare gli organismi notificati e aggiornare i certificati.
*** Periodo di tolleranza per i dispositivi di classe superiore che continuano a essere immessi sul mercato (se non vi sono cambiamenti significativi ed in presenza di certificato MDD valido).
 Austria
Austria  Belgium
Belgium  Canada
Canada  Denmark
Denmark  Finland
Finland  France
France  Germany
Germany  Italy
Italy  Mexico
Mexico  Netherlands
Netherlands  Norway
Norway  Poland
Poland  Spain
Spain  Sweden
Sweden  United Kingdom
United Kingdom  USA
USA 
